Flugbrandkrankheit der Gerste
Die Flugbrandkrankheit der Gerste (Ustilago nuda; s. Abb) ist eine samenbürtige Pilzkrankheit, bei der die Ähren zu einem Brandsporenlager umgebildet werden. Unter ökologischen Saatgutvermehrungsbedingungen muss diese Krankheit besonders berücksichtigt werden, da bereits mehr als 3 bzw. 5 flugbrandkranke Pflanzen auf 150m² zu einer Aberkennung des Bestandes für die Basis- bzw. Z-Saatguterzeugung führen.
Unterscheidung der verschiedenen Brandarten der Gerste
Der Flugbrand (Ustilago nuda = loose smut [Abb.links]) und der Schwarzbrand (Ustilago nigra = false loose smut) weisen die gleichen Krankheitssymptome auf: frühzeitiges Aufreißen der Brandsporenlager und verstäuben der Sporen. Beim Hartbrand (Ustilago hordei = covered smut) dagegen bleiben die Brandsporenlager bis zur Kornreife von einem Häutchen umschlossen. Die Konsistenz der Hartbrandähre ist plastisch-hart. Im Sporenkeimungstest gleichen sich allerdings Schwarzbrand und Hartbrand, da bei diesen beiden das Promycel Sporidien bildet. Diese beiden rufen Kornkeimlingsinfektionen hervor. Flugbrand bildet dagegen ein Dauermycel im Embryo.
Symptome und Krankheitsverlauf
Die Infektion geht von Sporenlagern aus, die sich auf einer kranken Pflanze anstelle der Samen gebildet haben. Über die Luft gelangen die Flugbrandsporen auf Narben und Fruchtknoten einer gesunden Gersten.
Die optimalen Keimtemperaturen für die Flugbrandsporen auf Narben und Fruchtknoten in einer gesunden Blüte liegen bei 18-20°C und einer relativen Luftfeuchte von 96-98% (1). In Regionen mit geringer Luftfeuchtigkeit wird Flugbrand deshalb auch selten gefunden (2). Wenn die Gerstenblüte bereits bestäubt wurde, die Samenanlagen sich zum Samen umbilden und insbesondere die Samenschale ausgebildet ist, können die Pilzhyphen sie nicht mehr durchdringen. Sind die Pilzhyphen aber schon eingedrungen, wachsen sie in den Embryo und bilden dort dickwandige Dauerhyphen (3). Daneben ist es auch möglich, dass Sporen auf dem Blütengrund direkt durch die Epidermis des Fruchtknotens hindurch wachsen, wodurch eine starke Schädigung des Embryos stattfindet.
Keimt das infizierte Korn, so wächst das Pilzmycel im Pericarp hauptsächlich intrazellulär, im Endosperm interzellulär, dringt auch in die Aleuronschicht und besiedelt zuletzt das Scutellum. Von dort wächst das Mycel interzellulär unmittelbar hinter dem Vegetationspunkt her, in die Halme, die Blätter und die Ährenanlage, und wird mit der Internodienstreckung aufwärts getragen (4). Normalerweise geht der Pilz in den Ährenanlagen der Wirtspflanze erst in der Blühreife zur Sporenbildung über.
Umgebungsbedingungen
Wenn die Gerste bei feucht-warmer Atmosphäre und trockenem Boden noch vor dem Ährenschieben geschlossen abblüht so wird die Infektion unmöglich gemacht (3). Kühles Wetter dagegen verlängert die Blütezeit und erhöht insofern die Infektionsmöglichkeit. Bedingungen, welche die Infektion mit Flugbrand während der Blüte begünstigen, sind Temperaturen von 18-25°C und 80-100% Luftfeuchte. Bei Temperaturen unter 12°C finden nahezu keine Infektionen mehr statt (5). Niedrige Temperaturen bei der Keimung verhindern den Befall, da nur bei genügend hohen Temperaturen der Pilz schnell genug in den Embryo vordringen kann (6). Keimt das Getreidekorn bei nahe 0°C dann wächst das Pilzmycel nicht mit. Findet die Keimung der Gerste bei höheren Temperaturen statt, so dass das Pilzmycel sofort zum Vegetationspunkt gelangen kann, so können darauf folgende tiefe Temperaturen den Befall nicht mehr vermindern (3).
Hohe Temperaturen um 23°C begünstigen die Brandährenentwicklung (3). Deshalb fördert späte Aussaatzeit im Frühjahr, sofern sie mit höheren Temperaturen verbunden ist, auch den Flugbrandbefall. Flugbrand tritt dann stärker in Sommer- als in Wintergetreide auf. Verschiedene Bodenarten und Stickstoffdüngung haben kaum einen Einfluss auf den Flugbrandbefall (7).
Beim Flugbrand handelt es sich also um eine wärme- und feuchtigkeitsbezogene Gerstenkrankheit.
Für eine fortgesetzte Saatguterzeugung unter ökologischen Anbaubedingungen, bei der eben keine chemisch-synthetischen Saatgutbehandlungsmittel eingesetzt werden, ist eine möglichst geringe Anfälligkeit anzustreben. Feucht-warme Witterung während der Keimung und der Blüte erhöht die Anfälligkeit der Gerste. Dem kann vom Landwirt durch geschickte Wahl des Saatzeitpunktes mit für den Flugbrand allzu kühlen Temperaturen entgegen gewirkt werden. Leider kann man sich nicht immer auf eine entsprechend günstige Witterung verlassen. Um auch in diesen Fällen, den Befall möglichst gering zu halten, sind Sorten erforderlich, die dem Pilzwachstum unter natürlichen Verhältnissen keinen Angriffspunkt bieten.
Lebensdauer von Flugbrandsporen
Bei Zimmertemperatur sinkt die Keimfähigkeit schon nach wenigen Monaten stark ab und erlischt nach einem Jahr. Bei Temperaturen von 0-2°C behalten die Sporen bis zu 9 Monate 50% Keimfähigkeit (2). Während die Brandsporen bei optimaler Lagerung noch 10 Jahre lang eine gute Keimrate aufweisen, ist die Lebensfähigkeit des Mycels im Saatgut zeitlich eng begrenzt. Nach einer Lagerdauer von über 2 Jahren sinkt die Befallsrate der aus dem infizierten Saatgut hervorgehenden Pflanzen (14).
Resistenztypen
Bezüglich des Befalls mit Flugbrand sind folgende verschiedene 'Resistenztypen' zu unterscheiden.
- "Cleistogamic"-Typ: Die scheinbare Resistenz (oder auch Pseudo-Resistenz (8)) geht mit einem geschlossenen Abblühen (Cleistogamie) einher, wodurch die Sporen nicht an den sich bildenden Samen gelangen können. Bei cleistogamen Varietäten sind die Schwellkörperchen (Lodiculae) ganz häutig und dadurch funktionslos (9). Daneben kann bei feucht-warmer Witterung und trockenem Boden die Blüte bereits in der Blattscheide des Fahnenblattes stattfinden, wodurch die Infektion ebenfalls unterbunden wird. Bei eigenen Untersuchungen in Darzau erwies sich nur die Sorte 'Sigrid' als cleistogam.
- "Embryo"-Typ: Bei der Embryoresistenz kann der Embryo nicht befallen werden (z.B. Un8-Resistenz). Für die Embryoresistenz wird die Geschwindigkeit der Cuticula-Bildung auf den Integumenten als Ursache diskutiert (4). Nach künstlicher Infektion ist kein Embryobefall festzustellen. 'AC Metcalfe' und 'Freedom' sollen über eine solche Embryoresistenz verfügen.
- "Hypersense"-Typ: Eine besondere Resistenzform ist die Überempfindlichkeitsreaktion, die sich durch das Absterben embryonalen Gewebes äußert. Bei starker Infektion erscheinen solche Sorten als hochresistent, da die befallenen Körner absterben. Bei schwacher Infektion sind sie allerdings hochanfällig und können auch schon einmal Blätter mit Flugbrandsporenlagern aufweisen. Diese Überempfindlichkeitsreaktion soll bei japanischen Herkünften häufiger sein und bei diesen zum Absterben der Pflanzen im jungen Entwicklungsstadium oder zu Kümmerwuchs führen (11).
- "Escape"-Typ: Bei der Ausbreitungsresistenz bzw. dem Entwachsen wird zwar der Embryo befallen, der Vegetationspunkt aber nicht erreicht (z.B. Un3/6-Resistenz). Bei Sorten mit Ausbreitungsresistenz wird eine Hemmung der Mycelausbreitung vom Scutellum in den Vegetationspunkt schon während der Keimlingsentwicklung beobachtet. Dieser Resistenztyp kann durch Nachweis des Erregers im Embryogewebe klassifiziert werden. Es handelt sich bei der Ausbreitungsresistenz also um eine Embryoanfälligkeit mit Altersresistenz (12). Diese Resistenz ist vielfach nachgewiesen worden in der Sorte 'Jet' und auch in den Sorten 'Conquest', 'Francette', 'Emir', 'Irania', 'Luna', 'Mirena(aus Emir)', 'Ramona(aus Emir)', 'Tintern(aus Emir)', 'Uta', 'Excelle' wurde diese Resistenzform nachgewiesen (13). Auch die resistenten Sorten 'Steffi', 'Astrid' und 'Carrero' können aufgrund von Analysen mit verschiedenen Flugbrandherkünften und wegen ihrer Abstammungen nur über die Un6-Resistenz verfügen.
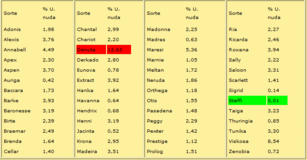
Sortenversuchsergebnisse zum Flugbrand an Sommergerste
Im Rahmen eines vom BMELV geförderten Forschungsprojektes wurden von 2002 bis 2004 die Sommergersten der Beschreibenden Sortenliste des Bundessortenamtes unter künstlichen und natürlichen Infektionsbedingungen einem Befall ausgesetzt.
Die nachfolgende Tabelle gibt den mittleren Befall in % unter natürlichen Infektionsbedingungen nach zwei Infektionszyklen mit der Flugbrandherkunft DE-29490 und Prüfung an den beiden Standorten Darzau und Dottenfelderhof wieder.
Die Ergebnisse aus den Sommergerstenevaluierunge wurden veröffentlicht unter:
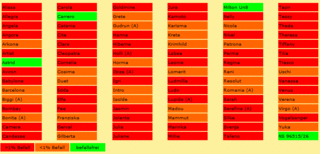
Sortenversuchsergebnisse zum Flugbrand an Wintergerste
Im Rahmen des Bundesprogramm Ökologischer Landbau wurden von Dr. Hartmut Spieß (IBDF) am Dottenfelderhof und in Darzau in Deutschland zugelassenen Handelssorten von Wintergersten unter natürlichen und künstlichen Infektionsbedingungen mit dem Inokulum DE-61118 geprüft. Nachfolgende Tabelle gibt einen Überblick über den Status der Anfälligkeit in drei Gruppen.
Die Ergebnisse aus den Wintergerstenevaluierungen wurden veröffentlicht unter:
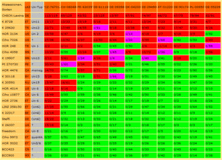
Zur Differenzierung von Flugbrandherkünften
Parallel zu den Sortenevaluierungen an Sommergerste wurden 11 Flugbrandherkünfte (Kennzeichung mit Landeskennung und Postleitzahl in der oberen Tabellenzeile) künstlich in die Blüte von 24 genetischen Ressourcen und Sorten inokuliert (siehe linke Tabellenspalte). Die nachfolgende Tabelle zeigt das Ergebnis hinsichtlich der "Anzahl befallener Pflanzen zur Anzahl aufgelaufener Pflanzen (Anzahl / Anzahl)" aus inokulierten Karyopsen insgesamt.
Die Ergebnisse zu den Flugbrandherkunftsdifferenzierungen mit umfangreichen Erläuterungen wurden veröffentlicht unter:
Das in Darzau für die Sortenevaluierung verwendete lokale Inokulum DE-29490 stammt von mit Flugbrand infiziertem ungebeiztem Züchtersaatgut und hat sich in unserem Versuchs- und Zuchtgarten selbst erhalten.
Die künstliche Infektion nach POEHLMAN
POEHLMAN (1945) suspendierte Flugbrandsporen in einer wässerigen Lösung und injizierte von dieser Sporenaufschwemmung mit einer Injektionsspritze in jede Gerstenblüte nach Durchstechen der Spelze einen Tropfen. Diese Methode hat sich vielfach bewährt und wurde auch von WICKE 1986 bei der letzten Untersuchung des deutschen Sommergerstensortimentes eingesetzt. Zuletzt nutzten ECKSTEIN et al. (2000) die Methode mit einer Konzentration von 1g Sporen pro Liter destillierten Wassers und injizierten die Sporenlösung in die Blüte bis die Lösung oben herausquoll. Nach eigenen Auszählungen enthält bei einer Konzentration von 1g Gerstenflugbrandsporen auf 1 Liter Wasser 1ml dieser Suspension ca. 300.000 Sporen. Für eine Ähre mit 30 Blüten wird in etwa 1 ml benötigt. Dadurch kommen auf eine Blüte ungefähr 10.000 Sporen.
Bei der POEHLMANschen Methode scheint die Konzentration in dem Bereich von 1 bis 10g Sporen/l von untergeordneter Bedeutung zu sein, da am Rande eines Wassertropfens die Sporen zahlreicher keimen, weil hier günstigere Bedingungen sind als im Innern eines Tropfens. Entsprechend waren bei OERTEL (1955) die Sporen auf der Narbe zahlreicher gekeimt als am Blütengrunde, auf dem sie längere Zeit vom Wasser vollständig eingeschlossen sind. Daher führt eine künstliche Infektion durch Injektion einer Sporensuspension nicht so leicht zu einer "Überinfektion", weil eine Infektion durch die Epidermis des Fruchtknotens trotz relativ hoher Sporenkonzentration kaum stattfinden kann. Andererseits wird durch den Tropfen in der Blüte die Luftfeuchtigkeit für die Keimung der Pilzsporen auf den Narbenästchen für eine längere Zeit im optimalen Bereich gehalten.
Nach OERTEL (1955) ist der Infektionserfolg vom Tag des Pollenstäubens bis zum dritten Tag danach gleich hoch und sinkt vom fünften Tag an sehr stark ab. Eine Infektion vor dem Pollenstäuben führt allerdings ebenfalls zu einer "Überinfektion".
Überinfektion
Eine trockene, künstliche Infektion mit Flugbrandsporen direkt in die Blüte hat zur Folge, dass Sporen auf dem Blütengrund direkt durch die Epidermis des basalen Teils des Fruchtknotens hindurch wachsen. Dies führt zu einer starken Schädigung des Embryos und bringt eine hohe Überschätzung der Anfälligkeit (Überinfektion) mit sich (OERTEL 1955).
Die natürliche Infektion unter Feldversuchsbedingungen
Zur natürlichen Infektion werden die zu prüfenden Muster auf 6 Saatreihen von jeweils 3m Länge zwischen zwei durch den ganzen Versuch hindurch gehenden Langparzellen mit jeweils 6 Drillreihen, auf denen eine bereits vom Vorjahr her infizierte Gerste angebaut wird, ausgesät (siehe Abbildung). Von diesen durchgehenden Parzellen mit 5% flugbrandbefallener Pflanzen kann die Infektion der Muster über den Wind erfolgen.
Nach der Abreife der Ähren wurden die Parzellen einzeln gedroschen und im Folgejahr mit jeweils 4 Wiederholungen auf je 2-3m² Fläche ausgesät. Im Folgejahr erfolgt dann das Auszählen kranker Pflanzen in Relation zur Anzahl aufgelaufener Pflanzen.
In den Jahren 2007 bis 2009 wurde ein System für die natürliche Ausbreitung von Flugbrand im Zuchtgarten unter ökologischer Bewirtschaftung und damit verbundener Selektion auf Resistenz entwickelt. In Teilen des Zuchtgartens wurden einerseits Saatstreifen mit Flugbrandbefall als Infektionsquelle angelegt und andererseits Parzellen mit befallsfreiem Saatgut einer anfälligen Sorte eingefügt, um den Grad der Ausbreitung festzustellen. Aufgrund der Ergebnisse wurde vorgeschlagen, Infektionsstreifen für die Flugbrandausbreitung in die Generationen von F4 bis F6 zu implementieren und eine künstliche Inokulation in die Blüte nur noch für eine Nachprüfung auf Resistenz in F7 und für neu zu prüfende Muster einzusetzen. Der Vorteil einer Selektion nach diesem Verfahren besteht darin, dass sofort mit jeder x beliebigen Resistenzquelle gearbeitet werden kann und es darüber hinaus möglich ist, mit geringem Aufwand die Entwicklung quantitativer Resistenzen auf der Basis nur gering anfälliger Zuchtstämme zu beginnen. Näheres hierzu findet sich im Abschlussbericht.
Förderung
Die Vorarbeiten im Rahmen der Vorevaluierung von Genbankmaterial und die grundlegenden Literaturrecherchen wurden 2001 von der Software-AG-Stiftung, Darmstadt unterstützt. Die Untersuchungen an Wintergerste wurden aus dem Bundesprogramm Ökologischer Landbau gefördert. Das Projekt "zur Flugbrandanfälligkeit im deutschen Sommergerstensortiment" wurde in den Jahren 2002-2005 vom Bundesministerium für Ernährung, Landwirtschaft und Verbraucherschutz Berlin finanziert. Das Projekt zum Zuchtgartenbefallsmanagement wurde in den Jahren 2007-2009 aus dem Bundesprogramm Ökologischer Landbau gefördert.
Literaturnachweis
1 LORIA,R.;WIESE,M.V.;JONES,A.L.(1982): Effects of free moisture, head development and embryo accessibility on infection of wheat by Ustilago tritici. Phytopath. 72, p1270-1272.
2 TAPKE,V.F.(1929): The role of humidity in the life cycle, distribution and control of the loose-smut fungus of wheat. Phytopath. 19, p103.
3 OERTEL,C.(1955): Untersuchungen zur Biologie des Gerstenflugbrandes (Ustilago nuda (Jens.) Kellerm.et Sw.). Kühn-Archiv 69, p552-602.
4 BATTS,C.C.V.(1955): Observations on the infection of wheat by loose smut. Trans.Brit.mycol.Soc. 38, p465-475.
5 OBST,A. (1993): Krankheiten und Schädlinge des Getreides. Gelsenkirchen: Mann.
6 DEAN,W.M.(1969): The effect of temperature on loose smut of wheat (Ustilago nuda). Ann.appl. Biol. 64, p75-83.
7 TIEMANN, A.(1925): Untersuchungen über die Empfänglichkeit des Sommerweizens für Ustilago trtitici und den Einfluß der äußeren Bedingungen dieser Krankheit. Kühn-Archiv 9, p405-475.
8 PEDERSEN,P.N. (1960): Methods of testing the pseudo-resistance of barley to infection by loose smut, Ustilago nuda (Jens.) Rostr. Acta Agricultur.... Scandinavica 10, p312-332.
9 FRÖIER,K;HOFFMANN,W.;SANDGREN,E.(1959): In: ROEMER-RUDORF, Handbuch der Pflanzenzüchtung 2, Getreide, 2. Auflage, Berlin:Parey, p276-379.
10 WICKE,H. (1986): Vergleichende Untersuchungen zur Resistenz von Sommergerstensorten gegen den Flugbranderreger Ustilago nuda (Jens.) Rostr.. Dissertation, Rheinische Friedrich-Wilhelms-Universitat, Bonn.
12 NIEMANN, E.(1961): Flugbrandresistente Gerstensorten. Z.Pflanzenzüchtung 45, p8-16.
13 METCALFE,D.R. (1966): Inheritance of loose smut resistance. III. Relationships between the "Russian" and "Jet" genes for resistance and genes in 10 barley varieties of diverse origin. Can.J.Plant Science 46, p487-495.
14 ROSZKO,A.;KOZERA,W.;KWATER,S.(1980): Tiplyw dlugosci przechowywania sztucznic Zukazonego ziarsice jeczmienia na zymatnose grzylni Ustilago nuda (Jens.)Rostr. (The time of storage of artificially infected grain of barley and itst effect on the viability of the mycelium of Ustilago nuda (Jens.)Rostr.) Acta Agrar.Silvest.Ser.Agrar 19, p161-170.
15 POEHLMAN,J.M. (1945): A simple method of inoculating barley with loose smut. Phytopathology 35, p640-644.
16 ECKSTEIN,P.E.;VOTH,D.;KRASICHYNSKY,N.;ROSSNAGEL,B.G.; SCOLES,G.J. (2000): Identification and Development of Markers for the Un8 Gene for True Loose Smut (Ustilago nuda) Resistance in Barley. LOGUE,S.(editor): Barley Genetics VIII, Proceedings of the 8th International Barley Genetics Symposium, 22.-27.Oct. 2000, Adelaide, ISBN 0-086396-680-2, Vol.2, p98-100.
17 OERTEL,C.(1955): Untersuchungen zur Biologie des Gerstenflugbrandes (Ustilago nuda (Jens.) Kellerm.et Sw.). Kühn-Archiv 69, p552-602.
18 MÜLLER,K.J.(1998): Erweiternde Kriterien für die Züchtung von Sommerspeisegerste im Organischen Landbau. [Dissertation, Institut für Organischen Landbau, Bonn] Berlin: Köster, ISBN 3-89574-303-8.
Zuletzt aktualisiert : 04.12.2009